Europäische Medizinproduktegesetze
Das Medizinprodukterecht-Durchführungsgesetz (MPDG) dient der Durchführung und Ergänzung der Verordnung (EU) 2017/745. Es ist durch Artikel 1 des Medizinprodukte-EU-Anpassungsgesetzes vom 28. April 2020 (BGBl. I S. 960) eingeführt worden.
Das MPDG löst in Deutschland schrittweise ab 26. Mai 2021 das Medizinproduktegesetz für alle Produkte im Anwendungsbereich der Verordnung ab.
Es regelt in Ergänzung der europäischen Gesetzte (MDD und MDR) die nationale Umsetzung. Dazu gehören:
- Behördliche Zuständigkeiten
- Strafbarkeit und Ordnungswidrigkeiten
- Ergänzende Anforderungen und Vorgaben, z.B. Medizinprodukteberater in Deutschland
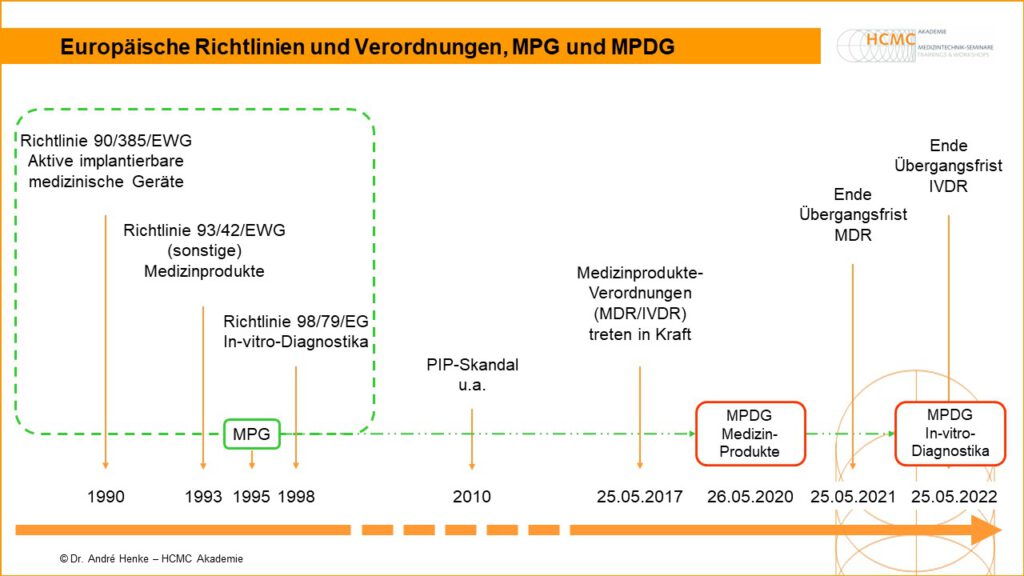
Seit 1990 gibt es europäische Gesetze, die die einheitliche Zulassung von Medizinprodukten regeln. Damit gilt die Zulassung von Medizinprodukten nach diesen Gesetzen automatisch für alle Länder in Europa.
Die ersten europäischen Gesetze waren Richtlinien:
Richtlinie 90/385/EWG
Aktive implantierbare
- 1990: Richtlinie 90/385/EWG – Aktive implantierbare medizinische Geräte
- 1993: Richtlinie 93/42/EWG – (sonstige) Medizinprodukte
- 1998: Richtlinie 98/79/EG – In-vitro-Diagnostika
Diese wurden 2017 von den Medizinprodukteverordnungen
- MDR (2017/745) – Medical Device Regulation
- IVDR (2017/746) – In vitro Diagnostica Regulation
abgelöst.
Mehr dazu in unseren Seminaren zum Medizinprodukteberater.
